Rappel de cours
L'énergie de l'atome ne peut prendre que des valeurs discrètes, caractéristiques de cet élément chimique. Ci-dessous, vous trouverez le diagramme des niveaux d'énergie de l'atome de sodium exprimés en électron-volt.

Le niveau fondamental correspond au niveau n=1, l'atome est stable. le niveau n égal l'infini correspond à l'état ionisé, l'atome a perdu un électron. Les autres niveaux sont les états excités de l'atome.
Les échanges d'énergie entre l'atome et rayonnement sont quantifiés.
L'énergie échangée entre l'atome et un rayonnement électromagnétique s'exprime par:
, représente l'énergie échangée en joules (noté J)
h est la constante de Planck et vaut :
est la fréquence du photon absorbé ou émis. Cette fréquence s'exprime en hertz (noté Hz)
la longueur d'onde du photon est donnée par : ; c est la vitesse de la lumière.

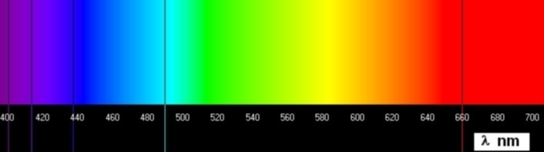
Le spectre de raies d'émission ci-dessus est caractéristique de l'atome d'hydrogène. Chaque raie correspond à la longueur d'onde d'un rayonnement d'énergie égale à la variation d'énergie de l'atome lors de sa transition d'un niveau d'énergie plus élevé vers un niveau plus bas. Les spectres d'émissions sont obtenus en décomposant la lumière émise par les lampes à vapeur de gaz de ces éléments.

Dans cet exemple le photon émis possède une énergie égale à
Le spectre de raies d'absorption de l'atome d'hydrogène est constitué de raies sombres sur fond clair dont les longueurs d'onde sont identiques à celles des raies colorées du spectre d'émission. Le spectre d'absorption est obtenu en décomposant la lumière blanche ayant traversée de l'hydrogène gazeux.
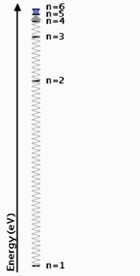
Dans cet exemple le photon absorbé possède une énergie égale à
Vous pouvez regarder les 7 premières minutes du film suivant pour approfondir ces notions : http://sfrs-streamer.sfrs.fr/ramgen/media-2/sfrs/real/realvideo/6205.rm
